Inhaltsverzeichnis:
Hier erhalten Sie Infos rund um den PH Wert im Aquarium, dessen Bedeutung sowie verschiedene Varianten diesen zu senken / zu verändern.
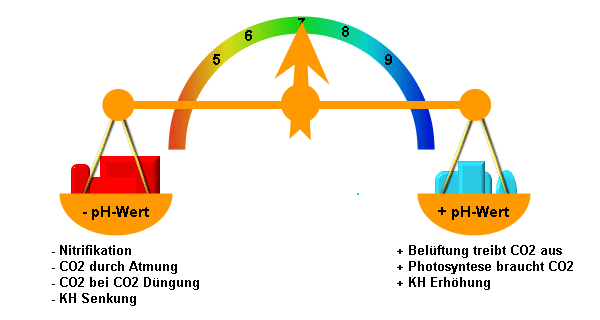
Schaubild zur Vereinheitlichung des PH Wertes:
Grundlagen zum PH Wert

Der pH-Wert gibt das Verhältnis der im Wasser gelösten Säuren und Basen zueinander an. Genau ausgedrückt gibt der pH-Wert die Konzentration an Wasserstoffionen H+ an.
H+-Ionen machen das Wasser sauer. Je mehr H+-Ionen vorhanden sind, desto saurer ist das Wasser und desto niedriger ist der pH-Wert. Für Wasser ergibt die Multiplikation von H+-Ionen und OH–-Ionen immer einen konstant gleichen Wert. [H+] x [OH–] = konstant ~ 10-14.
Wasser mit einem pH-Wert von 7 wird als neutral bezeichnet. Bei pH 7 ist die Konzentration von H+-Ionen genau gleich der Konzentration an OH–-Ionen. Wasser mit höherem pH-Wert wird als basisch oder alkalisch bezeichnet und Wasser mit niedrigerem Wert wird als saures Wasser bezeichnet.
Der pH-Wert ist ein logarithmischer Wert. Wasser mit einem pH-Wert von 7 enthält deshalb zehnmal mehr H+-Ionen und zehnmal weniger OH–-Ionen als Wasser mit dem pH-Wert 8.
Es gilt log([H+]) + log([OH–]) ~ -14. Ein pH-Wert von 6 bedeutet etwa 10-6 H+-Ionen und etwa 10-8 OH–-Ionen. Das heißt, es sind hundert Mal mehr H+-Ionen, als OH–-Ionen im Wasser.
Theoretisch ist auch destilliertes Wasser, Osmosewasser oder vollentsalztes Wasser neutral. Weil das Wasser schnell Kohlendioxid aus der Luft aufnimmt, kann sich aufgrund der Dreierbeziehung aber schnell ein pH-Wert von etwa 5,5 einstellen.
Unterscheidet sich der ph-Wert im Aquarium zu stark von den aus den Herkunftsgewässern gewohnten Werten, können Fische und Pflanzen geschädigt werden. Die meisten Fische sind von Natur aus daran angepasst, dass der pH-Wert innerhalb bestimmter Bereiche bleibt. Einige Fischarten überleben und laichen nur in Wasser, dessen pH-Wert sich innerhalb eines geringen Bereichs befindet, andere Arten benötigen solch spezielle pH-Werte nicht.
Die meisten Bakterien benötigen neutrale pH-Werte zwischen 6,5 und 7,5. Ihr Stoffwechsel arbeitet bei diesen Werten optimal und sie vermehren sich gut. Tiefere oder höhere pH-Werte verringern die Geschwindigkeit des Stoffwechsels der Bakterien. Deshalb werden z. B. in extrem sauren Gewässern, z. B. in Mooren, gestorbene Lebewesen mumifizert, die bei anderen pH-Werten schnell durch bakterielle Prozesse zersetzt werden würden.
- Fische aus extremen Weichwassergebieten sind daran angepasst, dass in ihrer Umwelt sehr wenige Bakterien vorhanden sind. Ihre natürliche Immunabwehr gegen bakterielle Erkrankungen ist deshalb nur schwach ausgeprägt. Diese Arten erkranken im Aquarium sehr schnell, weil in dort sehr viele Bakterien vorhanden sind.
- Der Stickstoffkreislauf, d. h. die biologische Filterung, im Aquarium ist bei niedrigen pH-Werten verlangsamt.
- Bei höheren pH-Werten entsteht mehr giftiges Ammoniak im Verhältnis zum weniger giftigen Ammonium.
- Nitrit ist bei niedrigen pH-Werten giftiger, weil mehr Nitrit NO2– in giftige salpetrige Säure umgewandelt wird.
Heimatgewässer mit neutralem Wasser mit pH-Werten zwischen 6,5 und 7,5:
Die meisten Fischarten und Pflanzenarten können in neutralem Wasser erfolgreich gehalten werden.
Saure Wasser mit pH-Werten zwischen 5,0 und 6,5:
Fische aus solchen Gewässern sind sehr empfindlich für bakterielle Erkrankungen und Ammoniakvergiftungen. Die biologische Filterung ist weniger wirksam. Schwermetalle sind in weichem Wasser giftiger.
Lösungen:
Der pH-Wert im Aquarium sollte niedrig sein. Es sollten weniger Fische als bei neutralen Werten gehalten werden, d. h. pro Gewichtseinheit Fisch soll mehr Wasservolumen zur Verfügung stehen. Ein größerer Filter sollte verwendet oder es sollten mehr Pflanzen zur Wasserreinigung gepflegt werden. Osmosewasser sollte verwendet werden. Wasseraufbereiter und gelöste organische Stoffe können gegen Vergiftungen durch Schwermetall helfen.
Basische Wasser mit pH-Werten zwischen 7,5 und 9,0:
Fische aus diesen Gewässern können sehr empfindlich für Nitritvergiftungen sein. Die biologische Filterung ist weniger effektiv als bei neutralem Wasser, aber effektiver als bei weichem Wasser.
Lösungen:
Der pH-Wert im Aquarium sollte hoch sein. Es sollten weniger Fische als bei neutralen Werten gehalten werden, d. h. pro Gewichtseinheit Fisch soll mehr Wasservolumen zur Verfügung stehen. Es ist darauf zu achten, dass der Gehalt von Nitrit und Ammoniak nicht zu hoch wird. Dazu ist eine gute biologische Filterung und Wasserwechsel erforderlich. Pflanzen helfen, den Gehalt an Ammoniak niedrig zu halten. Etwas Salz kann vorbeugend gegen Nitritvergiftungen helfen. Holz und Wurzeln sollten nicht zur Dekoration verwendet werden, weil sie den pH-Wert verringern könnten.
Starke Schwankungen des pH-Werts sind gefährlich.
Es kann wichtiger sein starke Schwankungen des pH-Werts zu verhindern als einen bestimmten pH-Wert zu erreichen. Plötzliche Änderungen des pH-Werts schaden den meisten Lebewesen im Aquarium. Die Karbonathärte puffert den pH-Wert. Je höher die Karbonathärte ist, desto stabiler ist der pH-Wert. Deshalb wirken sich Veränderungen beim CO2-Gehalt, z. B. durch CO2-Düngung und Photosynthese der Pflanzen, bei weichem Wasser stärker auf den pH-Wert aus als bei hoher Karbonathärte.
Der pH-Wert im Aquarium wird von verschiedenen Faktoren beeinflusst.
Ein wichtiger Einflussfaktor auf den pH-Wert ist der Gehalt an Kohlendioxid im Wasser. Weil Kohlendioxid in Wasser teilweise in Kohlensäure H2CO3 umgewandelt wird, sinkt der pH-Wert, je mehr Kohlendioxid im Wasser ist.
Wenn Kohlendioxid aus dem Wasser entfernt wird, z. .B. durch Belüftung des Wassers, wird Kohlensäure in Kohlendioxid umgewandelt und der pH-Wert steigt an.
Der pH-Wert ist eine logarithmische Größe, d. h. bei einer Änderung um den Faktor 1 verändert sich die Säurekonzentration um den Faktor 10. Entsprechend dramatisch können die Auswirkungen einer pH-Änderung auf die Aquarienbewohner sein.
Änderung des pH-Werts
Ideales Zubehör für den PH Wert im Aquarium:
Es gibt mehrere Methoden zur Senkung des pH-Werts:
- Schwierig kontrollierbar
- Aufwändig
- Nur für kleine Änderungen geeignet
- Kann bei Überdosierung zu CO2-Vergiftungen führen
- Hohe Anschaffungskosten
- Nur für kleine Änderungen geeignet
- Kann bei Überdosierung zu CO2-Vergiftungen führen
- Bewirkt nur kleine Änderungen des pH-Werts
- Bewirken nur kleine Änderungen des pH-Werts
- Färben das Wasser stark
- Bewirkt nur kleine Änderungen des pH-Werts
- Färbt das Wasser
- Enthalten meistens Säuren
- Preiswert
- Erfordern sorgfältigen Umgang
- Riskant bei unsachgemäßer Handhabung
- Enthärten das Wasser
- Hohe Anschaffungskosten
- Hoher Wasserverbrauch
- Enthärten das Wasser
- Hohe Anschaffungskosten
- Müssen regeneriert werden
- Erzeugen kein Abfallwasser
Kann der pH-Wert mit Zitronenextrakt eingestellt werden?
Zitronenextrakt enthält neben Zitronensäure organische Substanzen. In der Chemie werden organische Säuren wie Citrate, Acetate und Oxalate zur Einstellung bestimmter pH-Werte verwendet, weil sie gute Puffersysteme bilden. Im Unterschied zum Aquarium sind in den Reagenzgläsern aber keine Filterbakterien vorhanden. Bakterien verarbeiten die organischen Substanzen im so genannten Zitronensäurezyklus unter Verbrauch von Sauerstoff zur Energiegewinnung. Zitronensäure kann deshalb zu Bakterienblüten und Sauerstoffmangel führen. Nitratfilter werden aus dem gleichen Grund häufig mit Essigsäure gefüttert.
Da bei der Anwendung von Zitronensäure die Karbonathärte nicht vollständig zerstört wird, überlagert das Puffersystem Zitronensäure zudem das Puffersystem Karbonathärte-Kohlendioxid. Bei hoher Karbonathärte, also hoher Pufferkapazität, wird dann entsprechend viel Citrat benötigt. Je mehr Citrat die Bakterien zur Verfügung haben, desto mehr Sauerstoff verbrauchen sie. Da ständig Citrat nachdosiert werden muss, kommt es zu einer dauerhaften Bakterienblüte. Bakterienblüten führen z. B. zu einer hohen Keimbelastung für die Fische.
Huminsäuren können von Bakterien nur schwierig abgebaut werden. Sie bestehen praktisch aus den unverdaulichen Resten organischer Stoffe, die bei der Mineralisation übrigbleiben. Da die Pufferkapazität ähnlich ist wie bei Citraten, lassen sich auch mit Huminsäuren niedrige pH-Werte einstellen. Zusätzlich haben Huminsäuren andere positive Eigenschaften, z. B. wirken sie antibakteriell und pilzhemmend. Allerdings darf auch hier das Puffersystem Karbonathärte-Kohlendioxid nicht dominieren, d. h. die Wirkung tritt nur bei niedriger Karbonathärte ein.
PH Wert senken
Den pH-Wert mit CO2 senken

Muss der pH-Wert nur wenig gesenkt werden, kann evtl. eine CO2-Anlage verwendet werden.
Gleichzeitig werden damit die Pflanzen gedüngt. Bei stärkeren Senkungen muss aber zu viel CO2 in das Wasser geleitet werden.
Es kann dann zu Schäden an den Fischen kommen, z. B. Verätzungen der Kiemen.
Bei hoher Karbonathärte und hohem pH-Wert ist CO2 aus diesem Grund nicht geeignet, um den pH-Wert nennenswert zu verringern.
Den pH-Wert mit Torf senken

Torf kann den pH-Wert etwas senken. Torf wirkt als schwach saurer Kationenaustauscher. Die Kapazität liegt bei ca. 0,1 mol/Liter einwertige Ionen.
Das Aquarienwasser wird durch Torf gelbbraun verfärbt. Viele Fische kommen aus Gewässern, die auch in der Natur so gefärbt sind. Torf wirkt zudem antibakteriell. Durch die Färbung wird das Licht abgedunkelt. Lichthungrige Pflanzen können deshalb unter Lichtmangel leiden.
Torf setzt die Karbonathärte ebenfalls herab. Die im Torf enthaltenen Huminsäuren zerstören die Karbonathärte, wie andere Säuren auch.
Bei hoher Karbonathärte ist Torf ungeeignet. Die Karbonathärte wird höchstens um 2 bis 3° verringert. Es wäre viel zu viel Torf notwendig, um die Karbonathärte bzw. den pH-Wert wesentlich zu verringern.
Nach ca. 14 Tagen muss der Torf erneuert werden, weil er sonst mikrobiologisch abgebaut und das Wasser mit den Abbaustoffen belastet wird.
Den pH-Wert mit Eichenextrakt senken
Die meisten Eichenextrakte bestehen aus Salz- oder Phosphorsäure.
Den pH-Wert mit Säuren senken
Säuren zerstören die Karbonathärte. Eine Verringerung der Karbonathärte führt zu einem niedrigeren pH-Wert, wenn gleichzeitig der Gehalt an Kohlendioxid im Wasser gleichbleibt. Mineralische Säuren, z. B. Salzsäure, sind preiswert, können hoch konzentriert aber Verätzungen usw. hervorrufen. Organische Säuren, z. B. Zitronensäure, werden von Bakterien als Nahrung verbraucht und können so zu Bakterienblüten führen. Organische Säuren wirken aufgrund des Abbaus durch Bakterien relativ kurz. Bei wiederholter Anwendung wird die Wirkung immer geringer, weil die Bakterienzahl immer größer wird.
Bei unsachgemäßem Einsatz von Säuren kann es leicht zu einem Säuresturz kommen. Bei der Verwendung von Salzsäure steigt der Leitwert merklich an. Das Wasser muss außerhalb des Aquariums behandelt werden. Es können sonst starke Säurekonzentrationen im Aquarium entstehen. Der pH-Wert im Aquarium kann auch zu schnell und zu stark sinken. Säuren treiben CO2 aus dem Puffersystem aus Karbonat und Hydrogenkarbonat aus. Kurzfristig kann dabei viel CO2 freigesetzt werden. Das CO2 verflüchtigt sich zwar schnell, kann bei zu hoher Konzentration den Fischen aber trotzdem schaden. Säuren dürfen nur vorsichtig und mit entsprechenden Kenntnissen verwendet werden.
Auch die im Zoohandel erhältlichen Produkte, wie Tetra pH/KH minus enthalten entsprechende Säuren und müssen vorsichtig eingesetzt werden. Diese Mittel enthalten die Säuren in verdünnter Form und sind im Umgang deshalb nicht ganz so riskant wie unverdünnte Säuren.
Für spezielle Aufgaben, z. B. bei der Zucht anspruchsvoller Fischarten, die sehr geringe pH-Werte zur Zucht benötigen, kann der Einsatz von Säuren die einzige Möglichkeit sein, stabile und kontrollierbare Wasserverhältnisse einzustellen, die den natürlichen Bedingungen entsprechen. Die Gewässer aus denen viele solcher Fischarten stammen, haben pH-Werte deutlich unter 6 und kaum nachweisbare Leitwerte.
Den pH-Wert mit Osmoseanlagen oder Ionenaustauschanlagen senken
Bei hoher Karbonathärte sind Osmoseanlagen oder Ionenaustauscher geeignet, die Karbonathärte und in der Folge den pH-Wert zu verringern. Beide Anlagentypen erzeugen extrem weiches Wasser. Karbonathärte und pH-Wert lassen sich durch Mischung dieses Wassers mit Leitungswasser oder durch spezielle Aufhärtungssalze auf die gewünschte Härte einstellen. Mit geringen und unschädlichen Mengen CO2 oder Torf kann der pH-Wert dann fein eingestellt werden.
Die Gesamthärte senken
Die Gesamthärte kann nur mit einer Osmoseanlage gesenkt werden. Die anderen Methoden ändern die Gesamthärte nicht. Auch wenn im Leitungswasser andere unerwünschte Stoffe sind, z. B. Nitrit oder Phosphat, ist die Osmose die einzige Methode, mit der diese Stoffe entfernt werden können.
CO2-Düngung und Salzsäure
Wenn der pH-Wert mit Salzsäure verringert wurde, bleibt auch bei Düngung mit CO2 die HCO3-Konzentration konstant. Die Konzentration steigt nur geringfügig an. Die Mineralisation beeinflusst die HCO3-Konzentration im Wesentlichen. Steigt der Nitratgehalt im Wasser, sinkt die HCO3-Konzentration. Sinkt der Nitratgehalt aufgrund des Verbrauchs von Pflanzen oder durch Nitratatmung, steigt die Konzentration. In diesem Fall überwiegen die alkalischen Anteile der Mineralisation.
Eine plötzliche Senkung des pH-Werts kann die Mikrobiologie im Aquarium so stark stören, dass der Nitratgehalt stark steigt und ein Säuresturz folgt.
pH-Wert in kleinen Aquarien senken
Um auch in kleineren Aquarien ohne relativ hohe Kosten den pH-Wert senken zu können, stehen mehrere Verfahren zur Verfügung.
Eine einfache Möglichkeit ist, den wöchentlichen Wasserwechsel mit weichem Wasser durchzuführen. Da nur ca. 10 Liter in der Woche benötigt werden, ist es möglich, dazu weiches Wasser aus einem Bach, einem Tümpel, Regenwasser oder Osmosewasser zu verwenden. Osmosewasser wird von einigen Zoohandlungen angeboten. Vielleicht kann auch ein Aquarianer mit einer Osmoseanlage helfen.
Eine weitere Möglichkeit ist die Verwendung von Torf. Torf senkt die Karbonathärte. Dazu wird ungedüngter Torf verwendet. Ca. eine Hand voll Torf wird zerrieben und in einen Eimer mit Wasser getan. Die Mischung bleibt einige Tage stehen. Das überstehende Wasser kann als Wechselwasser verwendet werden. Je nach Torf ergibt sich ein pH-Wert von 4,2 bis 4,5.
Das Wechselwasser kann auch mit 3,5 %iger Salzsäure auf einen pH-Wert von 5 angesäuert werden. Bei einer Karbonathärte von 7° werden 25 ml je 10 Liter Wasser benötigt. Die Salzsäure wird mit einer Einwegspritze dosiert. Der pH-Wert muss kontrolliert werden. Es darf keine konzentrierte Salzsäure verwendet werden, da deren Anwendung riskant ist.
Eine etwas kostspieligere Variante ist die Verwendung von Eichenextrakt, der im Zoohandel erhältlich ist. Mittel die Phosphorsäure enthalten können jedoch Algenplagen verursachen.
Auch für kleine Aquarien gibt es entsprechend kleine und preiswerte CO2-Anlagen. Sie bestehen in der Regel aus einer Glocke, einem Schlauch und einer CO2-Flasche. Besonders preiswert sind Bio-CO2-Anlagen, die nach dem Prinzip der Hefegärung arbeiten. Solche Anlagen können auch mit einfachen, eigenen Mitteln hergestellt werden.
Eine Überdosierung von CO2 ist praktisch ausgeschlossen, wenn die Anlagen mit Diffusionsrohren ausgestattet werden, die z. B. relativ preiswert die Firma Tetra anbietet. Überschüssiges CO2 entweicht dann.
pH-Wert mit Säuren senken
Nur für Experten geeignet und vor allem nicht für Kinder geeignet
Wenn der pH-Wert mit Säuren gesenkt wird, werden in der Regel Salz- oder Phosphorsäure verwendet. Es gibt jedoch eine ganze Reihe anderer Säuren, die stärker sind. Dazu gehören Mineralsäuren wie Schwefel- und Salpetersäure, sowie verschiedene organische Säuren wie Essig- und Ascorbinsäure (Vitamin C). Sowohl die mineralischen als auch die organischen Säuren wirken über die Zerstörung der Karbonathärte. Da organische Säuren von Bakterien als Nahrungsquelle verwendet werden, können organische Säuren zu Bakterienblüten führen. Allerdings steigt die Karbonathärte und damit der pH-Wert nicht wieder an, wenn die organischen Säuren durch Bakterien abgebaut sind.
Die Karbonathärte steigt bei der Denitrifikation und bei der Aufnahme von Nährstoffen durch viele schnellwachsende Pflanzen. Die Pflanzen nehmen die Nährstoffionen auf und geben HC03– ab. Die Bakterien geben CO2 ab.
Säuren zerstören die Karbonathärte. Durch die Zerstörung der Karbonathärte sinkt der pH-Wert, wenn der Gehalt an Kohlendioxid im Wasser gleichbleibt. Um die Karbonathärte zu zerstören reicht es aus, wenn die verwendete Säure stärker ist als die Kohlensäure. Dazu reichen mittelstarke Säuren aus. Stärkere Säuren bringen also keinen Vorteil.
Da die Karbonathärte durch die Säure verringert wird, reicht das im Aquarium bei Fischatmung und Bakterienstoffwechsel entstehende CO2 oft aus, damit der pH-Wert zwischen 6,5 und 7 liegt. Allerdings kann der pH-Wert wieder stark ansteigen, wenn viele stark assimilierende Pflanzen vorhanden sind.
Nur erfahrene Aquarianer mit entsprechenden chemischen Kenntnissen sollten anorganische (mineralische) Säuren verwenden. Die Auswirkungen auf die Wasserverhältnisse sind schwierig zu kontrollieren. Bei unerfahrenen Anwendern entsteht leicht mehr Schaden als Nutzen. Es gibt Methoden zur Senkung der Karbonathärte und des pH-Werts, die wesentlich weniger risikoreich sind.
Säuren dürfen von Laien nur in verdünnter Konzentration eingesetzt werden. Die Aufbereitung des Wassers erfolgt außerhalb des Aquariums. Das aufbereitete Wasser wird am Besten an einer Stelle in das Aquarium geschüttet, an der gerade keine Fische schwimmen. Unverdünnte Säuren dürfen nur von Fachleuten verwendet werden. Es drohen Verätzungen usw.
Die Dosierung der Säuren kann nach der Formel 1° dKH = 0,36 mmol/l HCO3– berechnet werden. Benötigt wird die Konzentration der verwendeten Säure und die Karbonathärte. Um mol/l zu berechnen, müssen die Molekulargewichte der Verbindungen nachgeschlagen oder berechnet werden.
PH Wert in Teichanlage senken
Oftmals wurde in den Kommentaren gefragt ob einige Teile dieser Anleitung auch für Teichanlagen gehlten. Der PH Wert kann in Teichanlagen teilweise ähnliche behandelt werden – für ausführliche Informationen finden Sie hier eine Anleitung für PH Wert Senkungen in Teichanlagen.
Informationen zu einzelnen Säuren
Phosphorsäure
- Ist eine preiswerte Mineralsäure
- Erhöht den Phosphatwert
- Kann zu Algenplagen führen
- Phosphat reichert sich im Kies an.
Salpetersäure
- Erhöht den Nitratwert
- Kann zu Algenplagen führen
- Ist ein Oxidationsmittel
- Bildet durch die Oxidation giftige Gase (Nitrosegase)
- Ist unverdünnt so stark, dass fast alle Metalle aufgelöst werden
- Da die enthaltenen Sulfate für Fische giftiger sein sollen als Chlorid, ist Salzsäure geeigneter.
- Erhöht den Leitwert
- Ist preiswert in Apotheken erhältlich
- Ist eine organische Säure und kann zu Bakterienblüten führen
- Ist ein Reduktionsmittel und verbraucht deshalb Sauerstoff
- Ist preiswerter als Ascorbinsäure
- Ist eine organische Säure und kann zu Bakterienblüten führen
- Ist eine organische Säure und kann zu Bakterienblüten führen
Warum der pH-Wert im Aquarium anders ist als im Leitungswasser
Im Wasser sind Kohlendioxid und andere Gase gelöst. Das Kohlendioxid ergibt zusammen mit der Karbonathärte einen ganz bestimmten pH-Wert.
Im Aquarium diffundiert Kohlendioxid langsam aus dem Wasser in die Luft. Zwischen den Gasen im Wasser und in der Luft stellt sich an der Wasseroberfläche ein Gleichgewicht ein, das Absorptionsgleichgewicht. Für Kohlendioxid ist das Gleichgewicht bei einer Wassertemperatur von 20° C erreicht, wenn sich in einem Liter Wasser 0,51 mg Kohlendioxid befinden.
- Die Grünpflanzen verbrauchen Kohlendioxid im Rahmen der Assimilation bzw. Photosynthese.
- Bei der Atmung der Fische und der Mineralisation des Futters entsteht Kohlendioxid.
Entsteht in einem Aquarium weniger neues Kohlendioxid als durch die Diffusion in die Luft und durch den Verbrauch der Pflanzen verschwindet, sinkt der Gehalt an Kohlendioxid im Wasser. Aufgrund der Wechselwirkungen zwischen Kohlendioxid, Karbonathärte und pH-Wert steigt der pH-Wert, wenn sich der CO2-Gehalt verringert und die Karbonathärtegleich bleibt. Entsprechend sinkt der pH-Wert, wenn mehr CO2 erzeugt als verbraucht wird.
Der Gehalt an Kohlendioxid im Aquarium wird wie der Sauerstoffgehalt durch ein so genanntes Fließgleichgewicht bestimmt. Das Fließgleichgewicht ist das Verhältnis von CO2-Verbrauch zu CO2-Produktion. In jedem Aquarium stellt sich deshalb ein spezieller pH-Wert ein. Dieser Wert ist unabhängig vom pH-Wert im Leitungswasser. Gleiches gilt auch für den Gehalt an Kohlendioxid und Sauerstoff.
Zusätzliche Details
Der größte Teil des Kohlendioxids im Wasser ist physikalisch gelöst. Ein geringer Teil von etwa 0,1 % reagiert mit Wasser in einer Kette von Gleichgewichtsreaktionen chemisch stufenweise zu Kohlensäure (H2C03). Die Kohlensäure bildet in geringem Maße Hydrogenkarbonat und Karbonationen. Insgesamt liegt das Gleichgewicht auf der linken Seite, d. h. das physikalisch gelöste Kohlendioxid überwiegt.
Aus gelösten Salzen der Kohlensäure stammt der größere Teil der im Wasser enthaltenen Hydrogenkarbonat- und Karbonationen. Demgegenüber löst sich Kalziumkarbonat aus Kalkgestein im Wasser schlecht. Kalziumkarbonat wiederum reagiert mit Kohlendioxid und Wasser zu Kalziumhydrogenkarbonat, das sich in Wasser leicht löst.
Grünpflanzen benötigen zum Aufbau von Kohlehydraten Wasser und Kohlendioxid. Sie sind CO2-Produzenten. Licht liefert die zur Photosysnthese benötigte Energie. Kohlendioxid entnehmen die Pflanzen aus dem direkt im Wasser gelösten Kohlendioxid oder aus den Ionen des Hydrogenkarbonats. Bestimmte Wassermoosarten und der Wasserstern verwenden nur Kohlendioxid. Wasserpest, Krauses Laichkraut und Wasserhahnenfuß verwerten Kohlendioxid und Hydrogenkarbonationen.
Bei der Assimilation unter Verwendung von Hydrogenkarbonationen werden Hydroxidionen freigesetzt. Als Folge kann der pH-Wert stark ansteigen.
Bestimmte Bakterien verwerten Kohlendioxid bei der Oxidation anorganischer Ionen wie Ammonium-, Nitrit– und Sulfidionen. Fische verbrauchen Kohlendioxid bei der Atmung. Durch den Verbrauch von Kohlendioxid wird die Konzentration der Ionen auf der rechten Seite der Gleichgewichtskette durch eine Gleichgewichtsverschiebung nach links erniedrigt. Die Konzentration an Hydroxoniumionen (H30+) nimmt ab, der pH-Wert steigt.
Hydrogenkarbonationen wirken im Neutralbereich als Puffer. Damit spielen sie eine ökochemisch besonders wichtige Rolle. Sie binden überschüssige Hydroxoniumionen (H30+) und überschüssige Hydroxidionen (OH-). So gewährleisten sie einen weitgehend konstanten pH-Wert in Gewässern. Hydroxoniumionen reagieren mit Hydrogenkarbonat- bzw. Karbonationen. Als Folge verschiebt sich das Gleichgewicht in Richtung des freien Kohlendioxids.
Kann sich der ph-Wert ändern, wenn die Oberflächenbewegung geändert wird?
Durch eine geringere Oberflächenbewegung wird weniger CO2 aus dem Wasser ausgetrieben. Wenn alle anderen Bedingungen, wie Atmung, Mineralisation und Verbrauch durch Pflanzen, gleichbleiben, ändert sich das Fließgleichgewicht des CO2. Die Konzentration von CO2 im Wasser wird höher. Da CO2, Karbonathärte und pH in einer festen Dreierbeziehung stehen, sinkt der pH-Wert.
Durch eine größere Oberflächenbewegung wird mehr CO2 aus dem Wasser ausgetrieben. Der CO2-Gehalt im Wasser wird geringer. Der pH-Wert steigt an.
- Stärkere Fütterung
- Starker Rückschnitt von Pflanzen
- Schwächere Beleuchtung
Entsprechend steigt der pH-Wert bei gegenteiligen Maßnahmen.
Was ist ein Säuresturz?
Wenn im Aquarienwasser kein pufferndes Karbonatsystem vorhanden ist, können eingebrachte oder im Wasser entstehende Säuren den pH-Wert wegen der fehlenden Pufferung drastisch verändern. Beim Abbau von Futter kann z. B. Salpetersäure entstehen. Wenn kein Puffer im Wasser ist, kann der pH-Wert in stark saure Bereiche sinken. Wenn der pH-Wert innerhalb kurzer Zeit auf für Fische nicht verträgliche Werte absinkt, wird von einem Säuresturz gesprochen.
Der pH-Wert kann auch durch Laugen verändert werden. Dafür hat sich keine spezielle Bezeichnung eingebürgert.
Ideales Zubehör für den PH Wert im Aquarium:







“Fische verbrauchen Kohlendioxid bei der Atmung.”
Verbrauchen Fische nicht nur Sauerstoff bei der Atmung und geben sogar Kohlendioxid wieder ab?
Guten Tag,
Ich versuche den ph wert in meinen Aquarien zu senken von ph 7,8 bei KH 7 auf ca 7,0.
Mit jbl ph minus habe ich in einem 40 l Becken in mehreren Stufen 7,2 erreicht und wollte nach einigen Tagen dann weiter senken. Nach 2 Tagen war der ph Wert aber wieder bei 7,8!
Ich habe dann mit Osmosewasser den KH-Wert auf 4 gesenkt. Der ph Wert hat sich nicht verändert.
Nun habe ich in einem 3 Liter Becken ohne Fische, Pflanzen etc, also nur mit Wasser experimentiert. Halb Leitungswasser, halb Osmosewasser gibt KH 4 und ph 7,8. Dann Zugabe von einigen Tropfen “ph-minus” ergibt ph 6,8. Nach 1 Tag messe ich aber schon wieder ph 7,2 und er steigt weiter! Warum?? Keine Durchlüftung, keine Pflanzen, was macht das Wasser alkalisch?